I chelanti (in natura)
Le piante (e non solo: anche batteri, funghi, …) da millenni riescono comunque a nutrirsi e a prosperare, nonostante tutti i problemi che incontrano gli oligoelementi per venire assorbiti.
Infatti, esistono svariati meccanismi naturali che hanno consentito e consentono alle piante di assorbire questi elementi senza troppe difficoltà, al massimo richiedendo alle piante energia aggiuntiva.
Tra questi fattori, possiamo elencare: la capacità di scambio del terreno, meccanismi in grado di rendere il ferro solubile (come l’acidificazione, da parte della pianta, della zona attorno alle radici) o la produzione di sostanze in grado di gestire questi oligoelementi.
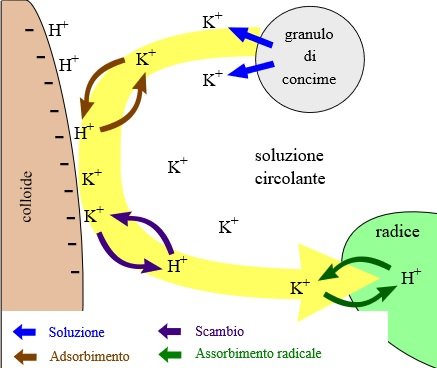
Queste sostanze, di natura estremamente varia, hanno la capacità di circondare gli ioni metallici e renderli elettricamente neutri e sono spesso dette chelanti o sequestranti. L’uomo, con il progresso delle Scienze e della Tecnica, è stato poi in grado di produrre chelanti artificiali, ispirandosi a quelli naturali.
Uno ione legato e reso elettricamente neutro ha, infatti, i seguenti vantaggi:
- non si incolla alle radici e riesce ad entrare più facilmente;
- non precipita con altri altri ioni;
- è meno tossico (ioni liberi di rame o zinco, ad esempio, possono essere tossici già a concentrazioni piuttosto basse; uno ione legato è almeno 50-100 volte meno tossico).
Cosa sono i chelanti?
Finalmente, dopo aver capito a cosa possano servire, possiamo iniziare a parlare di questi chelanti!
Iniziamo subito con il nome, chelante, che richiama la parola chela. I chelanti, infatti, sono sostanze che circondano e “afferrano” l’elemento da chelare proprio come farebbe una chela di un granchio con un qualcosa. Tale nome è stato usato per la prima volta negli anni Venti del Novecento.
Un’immagine potrà risultare utile giusto per avere un’idea visiva della cosa:
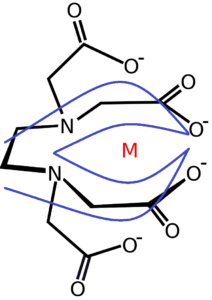
Il chelante è quindi una sorta di “anello” che isola l’elemento da chelare, facendogli perdere le caratteristiche ioniche – il complesso chelante-chelato è, infatti, neutro.
Se si tratta di un elemento nutritivo per le piante, queste ultime sono in grado di prelevare l’elemento chelato dal chelante, aprendolo. Dopo il prelievo, l’elemento nutritivo verrà spostato internamente dalla pianta, mentre il chelante rimarrà vuoto e libero di vagare nell’acqua.
Appena ne avrà la possibilità, il chelante formerà un nuovo composto con un altro ione libero (non chelato), se lo trova.
Tipi di chelanti
Di chelanti ne esistono un’infinità e, nel mondo naturale, molti devono ancora essere studiati e analizzati.
A livello di sintesi artificiale, contemporaneamente, sono in corso ricerche per trovarne di più efficaci, economici, eco-compatibili e biodegradabili.
Chelanti naturali
Ecco un breve elenco di chelanti naturali che possiamo trovare:
- amminoacidi, zuccheri e altri composti organici
- ad esempio quelli nel cosiddetto “carbonio organico dissolto” (DOC);
- acidi
- acidi umici e fulvici;
- ligninsolfonati
- solitamente sottoprodotti dalla lavorazione del legno, sono usati in particolare per chelare lo zinco (anche se possono chelare anche altri elementi) e per la pellettizzazione dei mangimi;
- glucoeptonati e gluconati
- composti derivanti dal glucosio, molto presenti, ad esempio, nei frutti;
- ammonio
- utilizzato in alcuni fertilizzanti per chelare rame e zinco, ad esempio;
- siderofori
- sostanze usate da batteri e funghi per poter assorbire il ferro; alcuni batteri patogeni lo usano per sottrarre il ferro legato all’emoglobina. Basti pensare che il chelante per il ferro secreto da batteri quali l’Escherichia coli o dal batterio della Salmonella, l’enterobactina, è in grado di chelare persino ioni di ferro presenti nell’aria;
- fitosiderofori
- sostanze usate dalle piante per chelare i metalli; fra i fitosiderofori più conosciuti ci sono acidi quali il citrico, l’acetico o il pirocatecolo.
Chelanti artificiali
Capostipite dei chelanti artificiali è quasi certamente l’EDTA (acido etilendiamminotetraacetico – nel seguito ometteremo questi nomi estesi), sintetizzato per la prima volta nel 1935 da Ferdinand Münz come sostituto dell’acido citrico.
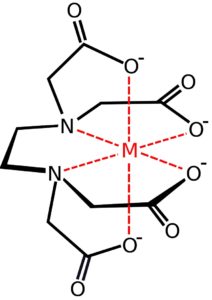
Dagli anni Cinquanta, l’EDTA è stato usato in maniera quasi ubiquitaria, non solo come chelante per concimi, ma anche per trattamento delle acque, rimedio contro l’intossicazione da metalli pesanti, nell’industria cosmetica, dei detergenti o alimentare.
Successivamente sono stati creati altri chelanti di sintesi, come:
- HEDTA o HEEDTA
- DTPA o acido pentetico
- EDDHA o EHPG
- EDDHMA
- EDDCHA
- HBED
- NTA
- EDG
- GLDA
- Glucoeptonati
… ognuno con le sue caratteristiche e campi d’impiego ottimali.