Il ferro in acquario ha un ruolo molto importante specialmente per le piante acquatiche, per le quali il ferro è un nutriente essenziale.
In questa scheda vedremo, in maniera sintetica, i principali punti riguardanti la fertilizzazione, in acquario, con ferro.
A cosa serve il ferro per le piante?
Il ferro è uno dei diciassette elementi nutritivi essenziali per le piante.
Il suo ruolo è quindi fondamentale per la crescita delle piante e, senza ferro, la pianta non può crescere.
Il ferro è necessario, per le piante, per la produzione delle clorofille.
In particolare, il ferro viene usato in vari enzimi e sostanze necessarie per la sintesi delle clorofille.
Ad esempio, il ferro viene usato nel sito attivo dell’enzima glutammil-tRNA reduttasi, necessario per la formazione di sostanze indispensabili (precursori) per la produzione delle clorofille, come l’acido 5-amminolevulinico.
Il ferro, inoltre, è un componente dei citocromi (proteine che consentono di utilizzare l’ossigeno all’interno delle cellule), che trasportano elettroni da un livello di energia alto a uno basso.
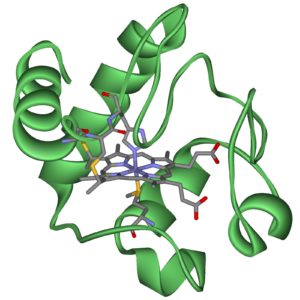
Il ferro, infatti, ha la proprietà di cambiare facilmente stato di ossidazione, passando da Fe2+ a Fe3+ e viceversa, cosa molto utile quando si tratta di trasportare elettroni (e quindi energia).
Dinamica del ferro
Il ferro ha comunemente due stati di ossidazione, Fe2+ e Fe3+, come abbiamo appena visto. Ne esistono anche altri (Fe4+, Fe6+ etc), ma per i nostri scopi ci interessano i primi due.
Nel dettaglio, abbiamo (usando la nomenclatura comune, anche se obsoleta):
- ferro ferroso, ovvero ione con due cariche positive, indicato con Fe2+ o Fe(II), relativamente raro poiché ossida facilmente a Fe3+;
- detto anche ferro solubile, ferro ridotto, ferro bivalente o ferro bianco.
- ferro ferrico, ovvero ione con tre cariche positive, indicato con Fe3+ o Fe(III), molto comune (ad esempio, la normalissima ruggine è ossido ferrico, Fe2O3);
- detto anche ferro insolubile, ferro ossidato, ferro trivalente o ferro nero.
Le piante possono utilizzare entrambi i tipi di ferro; tuttavia devono spendere maggiore energia per assorbire il ferro nello stato Fe3+.
Una volta assorbito il ferro, la pianta lo trasporta all’interno dei suoi tessuti, tenendolo sempre “isolato” a causa della sua reattività.
Ad esempio, la proteina ferritina tiene isolati gli atomi di ferro: 24 subunità di ferritina formano una sfera cava al cui interno ci possono stare, in sicurezza, fino a 4500 atomi di ferro [2].
Le piante possono, quindi, accumulare buone quantità di ferro, nello stelo e negli altri tessuti, potendo essere la disponibilità di ferro incostante, in natura.
Carenza di ferro
La carenza di ferro si manifesta solitamente come clorosi.
La clorosi è, sostanzialmente, la mancanza di sufficiente clorofilla nelle foglie, cosa che provoca un ingiallimento o un colore verde molto chiaro delle stesse. Talvolta possono essere presenti sfumature violacee che poi sbiancano.
Le venature, invece, rimangono verde scuro (non sbiancano, a meno di gravi carenze protratte nel tempo).

Se la clorosi è avanzata, le foglie possono crescere di dimensioni più piccole e, addirittura, cadere, se la carenza di ferro è grave e protratta nel tempo.
Purtroppo esistono varie cause della clorosi, per cui non è sempre detto che la colpa sia della carenza del ferro.
Ad esempio, una clorosi può essere causata anche da:
- eccesso di fosforo, calcio, manganese, rame
- carenza di azoto o magnesio
- carenza di manganese o zinco
Per identificare la carenza di ferro, si può innanzitutto osservare quali foglie sono diventate clorotiche per prime.
La clorosi ferrica, infatti, inizia dalle foglie più giovani e si propaga mano a mano alle foglie più vecchie e interne.
Questo accade perché il ferro è un elemento poco mobile all’interno della pianta.
Se lo si ha a disposizione, si può, in acquario, effettuare un test del ferro. Se abbiamo sintomi di clorosi ferrica e misuriamo valori di ferro nulli, molto probabilmente manca il ferro.

Attenzione che non tutti i test rilevano tutti i tipi di ferro: verificare sulla confezione!
Un ultimo controllo, infine, riguarda il pH: a pH basici (sopra il 7), l’assorbimento del ferro diviene sempre più difficoltoso, specialmente se l’acqua è ricca di carbonati.
Pertanto, anche se presente, in queste situazioni il ferro è difficilmente assorbito.
Eccesso di ferro
L’eccesso di ferro può risultare tossico per la pianta. Infatti, la pianta deve tenere isolato il ferro, poiché altamente reattivo (abbiamo visto, ad esempio, la ferritina).
Il ferro, infatti, può generare radicali idrossili (OH–), che possono danneggiare le proteine, i lipidi e il DNA.
L’eccesso di ferro può verificarsi tanto più facilmente quanto più basso è il pH, poiché un pH basso (sotto al 6, circa) facilita enormemente l’assorbimento di ferro.
Tra i sintomi di eccesso di ferro abbiamo:
- piccoli punti marroni nelle foglie basse che iniziano dalla punta e si propagano verso la base della foglia
- foglie arancio-marroni che muoiono
- radici ricoperte di sostanza nera, con varie radici morte
- carenza di manganese, poiché l’eccesso di ferro può inibire l’assorbimento del manganese.
In particolare, la carenza di manganese porta ad una clorosi su tutta la pianta, mentre la carenza di ferro comincia dalle parti alte e nuove. Questo può suggerire che, quando somministriamo molto ferro ma la carenza non si risolve, probabilmente non è il ferro a mancare, anzi: potremmo averne messo troppo!
Infine, vale la pena evidenziare che il ferro, in particolare quello chelato debolmente (gluconato, citrato etc) può risultare tossico, in alta concentrazione, per pesci e, soprattutto, invertebrati. È quindi bene fare attenzione con i dosaggi – non bisogna esagerare!
Come integrare il ferro in acquario?
L’integrazione del ferro in acquario può avvenire in vari modi.
Quasi tutti i fertilizzanti con oligoelementi per acquario contengono ferro, il quale può essere in varie forme (chelato, debolmente chelato etc).
Oltre a questi, esistono vari integratori specifici di solo ferro, sia per acquariofilia, sia generici per orto, giardino o piante da vaso.
Le forme più comuni con cui viene introdotto il ferro sono:
- ferro chelato fortemente (ferro EDTA, ferro DTPA, ferro EDDHA…)
- ferro chelato debolmente (ferro gluconato, ligninsolfonati)
- ferro ossidato (stick o fondo con argille, laterite, pezzetti di ferro arruginito etc)
Non è invece consigliabile usare sali di ferro quali solfato ferroso che, oltre ad essere poco stabili in acquario, apportano una grande quantità di elementi che non è bene far accumulare (come lo zolfo, per il solfato).
Per un dettaglio sulle varie forme chelate, abbiamo un articolo che tratta estensivamente la questione: Chelanti in acquario.
Le varie forme di ferro sono tutte utilizzabili dalle piante, cambia solo lo sforzo ad esse richiesto per poter assimilare l’elemento nutritivo. Alla fine dell’articolo sui chelanti, poco fa citato, c’è proprio un confronto fra i vari tipi di forme con cui il ferro può essere somministrato.
Dosaggi del ferro
Non esiste una quantità ideale di ferro in acquario, poiché ogni forma di ferro richiede concentrazioni diverse e, soprattutto, non è detto sia rilevabile dai test.
Ad esempio, il ferro gluconato è rilevabile solo per pochi minuti dopo l’inserimento, poiché viene assorbito o precipita rapidamente.
Al contrario, i chelati più forti (DTPA, EDDHA) richiedono dosaggi più consistenti e notevoli potenze luminose per essere assorbiti.
Indicativamente, volendo un numero, anche se da prendere con le molle, direi che 0.1-0.5 mg/l di ferro siano più che sufficienti per le piante.
Alcune leggende metropolitane sul ferro
Purtroppo da vario tempo circolano alcune dicerie sul ferro come fertilizzante per le piante d’acquario.
Ne elenchiamo alcune, giusto per interromperne un po’ la circolazione.
Fertilizzare l’acquario con solo ferro
Spesso si dice che basti fertilizzare solo con ferro.
Questo nasce dal fatto che spesso il ferro è l’elemento di cui pare ci sia più carenza, vedendo la clorosi.
La clorosi, in effetti, capita dove non si fertilizza e spesso la clorosi viene automaticamente associata al ferro (anche se dovuta ad altro, come al magnesio).
La Legge del Minimo (o, impropriamente, di Liebig) ci spiega che fertilizzare con un solo elemento raramente è la soluzione. Quindi, salvo casi particolarissimissimi, una fertilizzazione di solo ferro è sostanzialmente errata.
Le piante possono assorbire solo il ferro bivalente (Fe2+).
No, le piante possono assorbire il ferro trivalente (Fe3+), anche rendendolo bivalente per mezzo di vari meccanismi (acidificazione del substrato, fitosiderofori etc).
Perciò, eventuale ferro trivalente, come quello presente nel fondo, è utilizzabile dalle piante.
Il ferro serve per avere le piante rosse
Il ferro serve alle piante di tutti i colori, essendo un componente fondamentale, tra l’altro, per la formazione delle clorofille.
Tuttavia non è il solo ferro quello che fa diventare le piante rosse.
Lo dimostra il fatto che uno può immettere tutto il ferro che vuole, ma può ritrovarsi con le foglie verdi. Viceversa, possiamo avere piante rosse e ferro non misurabile o quasi.
Infatti, il colore rosso delle piante non è dovuto al ferro in sé quanto piuttosto ai pigmenti presenti nelle foglie. La produzione di pigmenti non dipende solo dalla fertilizzazione ma dipende anche dalla luce e dall’acquario in generale.
Pertanto, se non abbiamo le piante rosse, il ferro non è detto sia il colpevole.
Bibliografia e Crediti
[1] Antisense HEMA1 RNA Expression Inhibits Heme and Chlorophyll Biosynthesis in Arabidopsis A. Madan Kumar, Dieter Söll, Plant Physiology Jan 2000, 122 (1) 49-56; DOI: 10.1104/pp.122.1.49
[2] Iron stress in plants, Erin L. Connolly, Mary L. Guerinot, Genome Biol. 2002, 3(8)
http://extension.illinois.edu/focus/index.cfm?problem=chlorosis
Clorosi su pianta terricola: Di Frank Vincentz – Opera propria, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=3649106
Ferro (copertina): By Alchemist-hp (talk) (www.pse-mendelejew.de) – Own work, FAL, https://commons.wikimedia.org/w/index.php?curid=10115787