Questa è la traduzione dell’articolo Mycobacteriosis in Aquarium Fish di Diana Walstad, inizialmente pubblicato nel 2009, nella sua versione attualmente più aggiornata di Maggio 2017.
L’originale, in Inglese, è disponibile per il download sul sito web dell’autrice.
Si ringrazia vivamente la dottoressa Walstad per aver permesso la traduzione e la pubblicazione dell’articolo!
Micobatteriosi nei pesci d’acquario
Nell’estate del 2004, per vent’anni avevo allevato e riprodotto pesci arcobaleno senza alcun problema.
Dopo aver aggiunto quattro nuovi pesci ad un acquario, uno dopo l’altro questi pesci sono morti nel giro di sei mesi.
Quando i sintomi sono comparsi sugli altri compagni di vasca, pesci che ho allevato sin da quando erano nell’uovo e che sapevo essere in salute, ho iniziato a sospettare di una malattia infettiva.
Un veterinario specializzato nelle malattie dei pesci ha esaminato due pesci, i cui unici sintomi erano delle piccole erosioni attorno alla bocca.
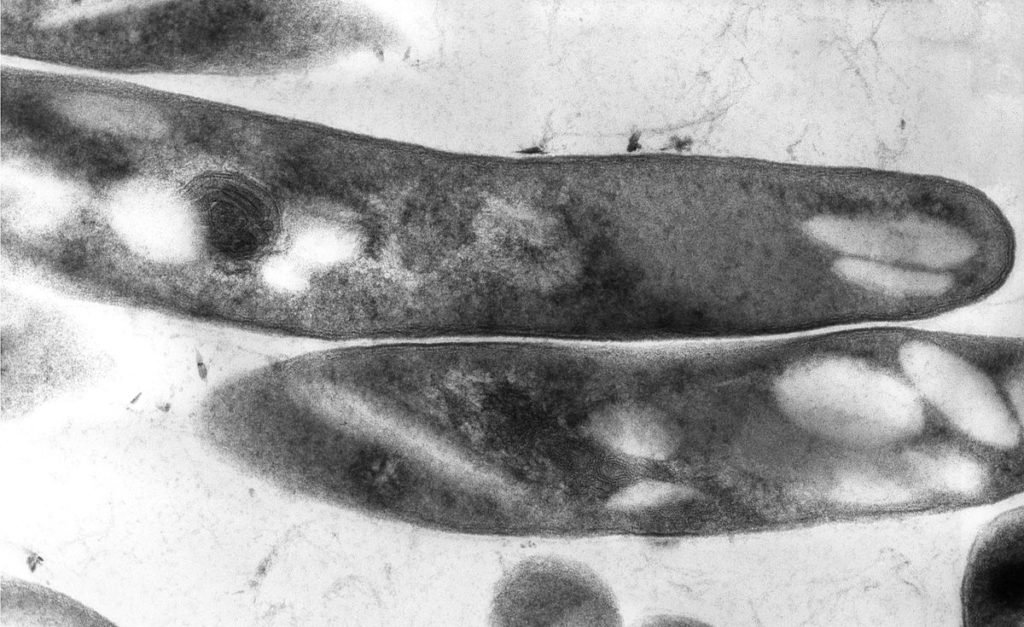
L’esame istologico ha mostrato che gli organi interni di entrambi i pesci erano crivellati di granulomi contenenti batteri acido-resistenti.
I miei pesci avevano la micobatteriosi – una comune malattia batterica di pesci e rettili, incurabile. Angosciante!
I miei pesci stavano per morire tutti.
La micobatteriosi (MB o tubercolosi dei pesci) è considerata la prima fra le malattie croniche dei pesci d’acquario [4]. È stata documentata per la prima volta su una carpa, nel 1897.
Nel corso degli anni, la malattia non si è placata, causando metà delle morti di pesci per cause sconosciute. Poiché i pesci non mostrano sintomi costanti o distintivi, gli acquariofili sottostimano la sua diffusione.
Se un pesce appena acquistato smette di mangiare e muore dopo poche settimane o mesi, molti non sospetterebbero la micobatteriosi (e ancora di più non saprebbero di cosa si tratti!).
Oltre a questo, la micobatteriosi cronica indebolisce il sistema immunitario dei pesci rendendo il pesce altamente vulnerabile a tutte le altre malattie.
Mi chiedo quanti acquariofili abbiano attribuito la morte dei loro pesci ad altri patogeni, quando il problema sottostante era una micobatteriosi cronica…
Episodi di micobatteriosi sono stati riportati in laboratori scientifici pulitissimi, in zoo, in allevamenti commerciali di pesci, in laghetti etc.
I pesci in natura possono ammalarsi e si ammalano. Tuttavia la micobatteriosi è un problema molto più comune nei pesci d’acquario che nei pesci in natura [20].
Se tutto va bene, questo articolo aiuterà gli acquariofili e gli allevatori a tenere lontana la malattia dai loro acquari e – nel caso i pesci dovessero infettarsi – gestire il problema in maniera più efficace.
Diffusione della malattia
I pesci possono morire in qualche giorno o settimana da un’infezione maggiore di batteri. Tipicamente, però, i pesci sviluppano una malattia cronica con vari sintomi: ulcere sulla pelle che non guariscono, emaciamento, nuoto disordinato, letargia, esoftalmo, gonfiore del ventre (edema o ascite), blackhead [NdT: malattia dei ciclidi che causa un annerimento della testa causato da un’influenza dei batteri sulla produzione di melanina], scarse riproduzioni, deformità della colonna vertebrale del pesce etc.
La micobatteriosi può essere confermata solo da un’autopsia e vari test di laboratorio. All’atto dell’autopsia, dei granulomi (noduli biancastri da 0.05 a 4 mm di diametro) possono essere visti nella milza e nei reni; questi organi, inoltre, solitamente rosso-marrone, presentano un motivo biancastro e grumoso.
Un esame istologico sull’acido-resistenza può confermare che i noduli non sono causati da batteri del genere Nocardia o da altri parassiti.
Tuttavia, basandosi sulla diffusione della micobatteriosi negli acquari, i granulomi generalmente indicano micobatteriosi.
Un gran numero di ricercatori hanno tentato – con varie colture e studi di genetica – di quantificare la presenza della micobatteriosi negli acquari.
Dei ricercatori cechi [27] hanno trovato che dei 70 pesci portati alla loro clinica veterinaria da vari acquariofili, a causa di morti inspiegabili, il 63% aveva micobatteriosi.
Dei ricercatori italiani [45] hanno studiato 387 pesci malati (rappresentanti 32 specie d’acqua dolce e 12 specie marine) da acquari di varie persone. Lo studio ha evidenziato che il 47% dei pesci conteva un gran numero di batteri che causano la malattia.
In una ricerca separata, in Spagna, Gomez [15] ha raccolto 200 pesci, rappresentanti 24 specie, debilitati, in maniera casuale da vari negozi e acquari privati. Tutti i pesci mostravano segni di malattia cronica (lesioni persistenti alla pelle, addome gonfio, cattivo stato generale, etc). Dei 200 pesci, il 41% aveva la micobatteriosi. Delle 24 specie rappresentate nell studio, tutte le specie avevano almeno un esemplare affetto. Metà dei 34 guppy debilitati aveva la micobatteriosi.
I batteri che causano la micobatteriosi sono tutti del genere Mycobacterium, che è diviso in due gruppi:
- i patogeni dell’uomo, quali M. tuberculosis e M. leprae, che causano, rispettivamente, la tubercolosi e la lebbra, e non sono in grado di vivere al di fuori dell’ospite umano;
- i micobatteri ambientali, che si nutrono di materia organica e si trovano ovunque – nel terreno, nelle acque, nell’acqua di rete, nell’acqua in bottiglia etc [12]
In natura, i micobatteri ambientali sono solitamente presenti in piccolo numero. Uniche eccezioni sono gli acquitrini e i terreni torbosi [24]. L’acidità, i bassi livelli di ossigeno etc in questi ambienti inibiscono la crescita di batteri in competizione, consentendo dunque ai micobatteri di crescere incontrastati.
Al 2010, sono state riportate 140 specie di micobatteri ambientali [16], ma i tassonomisti continuano a scoprirne altre. I micobatteri ambientali hanno caratteristiche (riportate in Tabella 1) che li differenziano dagli altri batteri. Ad esempio, crescono molto lentamente. Persino il “veloce” M. fortuitum richiede 4.6 ore per raddoppiare di numero, mentre l’Escherichia coli richiede solo 20 minuti.
Tabella 1. Caratteristiche dei micobatteri ambientali
Molte delle caratteristiche di seguito elencate derivano dal fatto che i lipidi costituiscono oltre il 60% della membrana esterna dei micobatteri. (Per comparazione, questa percentuale è solo dell’1-4% nei batteri Gram-positivi e del 20% nei batteri Gram-negativi [44]).
Questa copertura esterna, idrofobica, rende i micobatteri resistenti ai composti solubili in acqua (antibiotici, disinfettanti, succhi gastrici, tinte, etc). Spiega inoltre perché i micobatteri ambientali si trovino di preferenza sulla superficie dell’acqua e nei biofilm [12].
- Gram-positivi, acido-resistenti, aerobi, non-mobili.
- Resistenti ai disinfettanti a base di cloro.
- Crescita molto lenta (raddoppio della popolazione da 2 a 48 ore [33]).
- Estrema resistenza in condizioni di inedia (possono sopravvivere per anni in acqua distillata [33]).
- Non formano spore ma possono sopravvivere per anni dentro alle cisti di amebe infette [30].
- Sopravvivono e si moltiplicano nei protozoi.
Uno studio su pesci malati ha mostrato una varietà di specie associate alla micobatteriosi (Tabella 2).
M. fortuitum è stato il più comune ad essere trovato nei pesci malati. Tuttavia la sua presenza nei pesci malati può essere dovuta più alla sua alta diffusione ambientale, che alla sua virulenza.
Nella pratica, le specie effettivamente scatenanti la micobatteriosi possono essere irrilevanti. Le specie meno virulente possono causare altrettanta devastazione delle specie più aggressive (e viceversa). Ad esempio, la maggior parte degli scienziati non ritiene M. gordonae un patogeno dei pesci. Eppure, era l’indiziato per grosse mortalità in diversi allevamenti asiatici di guppy [36].
Una forma di M. peregrinum ha distrutto un’intera colonia di preziosi pesci zebra da laboratorio [NdT: i pesci zebra sono utilizzati in laboratorio come modello per lo studio delle tubercolosi].
I ricercatori avevano previsto che sarebbe stata particolarmente virulenta. Tuttavia, quando testata sperimentalmente, è risultata essere molto meno infettiva di una specie di M. marinum che ha causato solo moderati sintomi in un altro laboratorio di ricerca [40].
Ogni specie di micobatterio ambientale – in numero sufficiente e nelle giuste condizioni – può causare la micobatteriosi.
Detto questo, M. marinum è considerata, generalmente, la specie più infettiva nei confronti dei pesci e quella più frequentemente trovata nelle infezioni dell’uomo (la cosiddetta “fish tank syndrome”, “sindrome dell’acquario”). È sufficientemente aggressiva da superare la barriera fra le specie.
I micobatteri ambientali non sono patogeni per forza
Beran et al. [6] hanno studiato 6 acquari, ben stabili e apparentemente normali, alla ricerca di micobatteri (Tabella 3).
I ricercatori hanno isolato numerose specie di micobatteri (come M. fortuitum, M. chelonae etc) nell’ambiente – lumache, filtri, biofilm superficiali, piante, pesci etc.
Nessuno dei 19 pesci di cui è stata fatta l’autopsia avevano i granulomi caratteristici della micobatteriosi. Alcuni pesci avevano micobatteri, ma le specie erano le stesse presenti nell’acquario – lumache, piante, detriti sul fondo, nel filtro e sul vetro.
Molto probabilmente, il numero di micobatteri era insufficiente per causare malattia. Da notare che non è stato trovato alcun M. marinum.
I micobatteri ambientali sono parte degli ambienti naturali, dunque chiunque si aspetterebbe di trovarli anche negli acquari e nei pesci. Sfortunatamente, molte ricerche non quantificano la presenza di micobatteri nei pesci o nei loro ambienti. Elencano solo le specie trovate. Questo deriva dalla tradizione per cui se un laboratorio trova una singola colonia, questa è sufficiente per una diagnosi di malattia.
Oltre a questo, le procedure standard di coltura uccidono, senza volerlo, il 99.9% dei micobatteri effettivamente presenti [2].
I micobatteri entrano nei pesci attraverso la bocca e non attraverso le branchie o la pelle [17]. La digestione non uccide i micobatteri [12, 33], dunque ci si aspetterebbe di trovare micobatteri vivi nell’intestino, nelle feci [32] e nei detriti sul fondo dell’acquario.
I ricercatori [17] hanno trovato M. fortuitum negli intestini di 9 su 18 pesci zebra apparentemente in salute. Nessun pesce aveva granulomi o infiammazioni.
8 dei 9 pesci, dopo coltura per micobatteri, avevano da una a 20 colonie e solo nell’intestino. Un pesce, invece, aveva 400 colonie nell’intestino e qualche M. fortuitum nel fegato e nella milza.
Il fatto che M. fortuitum fosse stato in grado di oltrepassare le pareti intestinali del pesce e invadere fegato e milza potrebbe far supporre che questo pesce fosse ad elevato rischio di sviluppare la micobatteriosi.
I micobatteri ambientali probabilmente costituiscono una piccola frazione della microflora normalmente presente nell’intestino. Gli altri batteri aiutano a tenere sotto controllo il numero di micobatteri ingeriti, privandoli dei nutrienti e posti di insediamento nell’intestino.
La malattia potrebbe quindi svilupparsi quando la flora intestinale viene intaccata improvvisamente, ad esempio da un trattamento antibiotico.
La disinfezione e la pulizia aiutano i micobatteri ambientali
Ironia della sorte, gli allevatori scrupolosi aumentano fortemente il rischio di micobatteriosi con la disinfezione dei loro acquari.
I micobatteri sono molto più resistenti agli agenti chimici (antibiotici, detergenti, candeggina etc) degli altri batteri.
Ad esempio, i micobatteri sono da 10 a 100 volte più resistenti a cloro e clorammina del comune batterio Escherichia coli [26].
I micobatteri formano rapidamente dei biofilm, che a noi appaiono come una patina, ma che in realtà sono comunità organizzate di alghe, protozoi e batteri. Una volta insediati nel biofilm, i micobatteri sono estremamente più resistenti di quando sono in sospensione in acqua (Tabella 4). Ad esempio, un trattamento di 30 minuti con 800 ppm di cloro (circa 15 ml di candeggina in un litro d’acqua) può eradicare M. marinum ma non M. fortuitum su biofilm.
I protozoi forniscono protezione aggiuntiva ai micobatteri. I micobatteri ambientali, nascosti nelle cisti di amebe infette, sono stati in grado di sopravvivere per 24 ore all’esposizione di 15 mg/litro di cloro gassoso [1].
Le tecniche di laboratorio necessarie per isolare ed effettuare colture di micobatteri da pesci malati solitamente richiedono settimane o mesi [4, 13, 36]. I tecnici di laboratorio devono uccidere i microorganismi che crescono rapidamente, i quali spesso contaminano i campioni di tessuto, altrimenti, batteri, funghi e muffe cresceranno sulla coltura in pochi giorni, rendendo impossibile l’identificazione dei micobatteri.
I tecnici di laboratorio trattano (“decontaminano”) i campioni di tessuti dei pesci con un cocktail molto potente (un miscuglio di idrossido di sodio, verde di malachite e detergenti) prima di posizionarli sui terreni di coltura. Il mezzo di coltura, a sua volta, contiene solitamente antibiotici per uccidere eventuali altri batteri. Inevitabilmente, molti micobatteri vengono distrutti. Tuttavia, quelli che sopravvivono possono moltiplicarsi liberamente, cosicché i ricercatori possano verificarne la presenza.
I trattamenti delle acque, come la decontaminazione durante le colture in laboratorio, selezionano i micobatteri e inevitabilmente ne accrescono il numero. Questo “arricchimento dei micobatteri” è comune negli impianti di potabilizzazione dell’acqua [26]. I trattamenti con cloro/clorammine da una parte riducono il numero di micobatteri da 55 per millilitro a 0.04. Tuttavia lungo la rete di distribuzione, la popolazione di micobatteri è aumentata fino a 700 per millilitro [11].
Il trattamento delle acque uccide i batteri, fra cui i micobatteri. Tuttavia i micobatteri sopravvissuti formano rapidamente dei biofilm nelle tubazioni, i quali rilasciano continuamente micobatteri nell’acqua.
I ricercatori hanno trovato – in media – un aumento di 25000 volte nel numero di micobatteri nelle reti uscenti da 8 diversi impianti di trattamento [11].
I micobatteri possono sopravvivere e prosperare in ambienti poveri di nutrimenti (“puliti”), che invece fanno morire di fame gli altri batteri.
Steinert et al. [37] hanno mostrato questo sperimentalmente quando hanno posizionato l’E. coli e micobatteri (M. avium) in contenitori senza nutrienti. Dopo 10 giorni, la popolazione di M. avium è aumentata di 72 volte mentre la popolazione di E. coli è calata di 20 volte.
In un mezzo nutriente, E. coli ha raddoppiato la popolazione in un tempo pari a 20 minuti, mentre M. avium ha impiegato oltre 15 ore.
Questo significa che, dopo 15 ore, un singolo M. avium si è diviso in due. Nello stesso tempo, E.coli si è diviso ogni 20 minuti (o 45 volte) e, a livello teorico, ha aumentato la popolazione da un batterio a quasi quarantamila miliardi di batteri!
La disinfezione regolare può controllare le malattie comuni, ma con i micobatteri può ritorcersi contro di noi.
Un allevamento di pesci zebra [29] è stato cominciato con uova sterilizzate, ha usato un sistema di filtrazione a raggi UV e disinfettava le vasche ogni sei settimane. Nonostante tutta la pulizia, l’allevamento ha avuto epidemie distruttive di M. marinum per vari anni.
Gli acquari disinfettati con acqua molto pulita sono privi di nutrienti per la crescita dei batteri comuni. Forniscono quindi la perfetta nicchia ambientale per l’insediamento di numerosi micobatteri. Questo spiega perché gli allevamenti di pesci zebra, dove i pesci sono sottoposti a continue cure e condizioni ultra-pulite, abbiano frequenti epidemie di micobatteriosi [4, 22, 29, 40, 42].
Ogni situazione che inibisce gli “ordinari” batteri, quasi certamente aumenterà il numero dei micobatteri. Anche se una disinfezione dovesse uccidere con successo tutti i micobatteri, gli acquari presto verrebbero reinvasi dai micobatteri presenti nell’ambiente.
Studi sulle piscine
Lo studio di Angenent [2] di una piscina di un ospedale per terapie con acqua calda non solo documenta quanto un ambiente pulito e disinfettato possa arricchirsi di micobatteri ma quantifica anche la presenza di micobatteri nelle varie parti della piscina – filtri, biofilm, acqua e aria soprastante.
È da notare che i ricercatori abbiano usato dei metodi di ricerca (conta diretta dei batteri combinata con analisi genetiche) che sono risultati essere circa 1000 volte più sensibili dei metodi standard di coltura in laboratorio.
Nonostante la piscina fosse dotata di sistemi di disinfezione “allo stato dell’arte” e controllata secondo le direttive della pubblica sanità, i bagnini e altri lavoratori nell’area della piscina subivano infezioni respiratorie. (L’acqua era filtrata con filtri a sabbia sotto pressione, seguiti da filtri sterilizzatori ai raggi UV e quindi addizionata con acqua ossigenata).
Alla fine, Angenent [2] ha provato che i micobatteri nell’acqua della piscina hanno causato infezioni respiratorie. Un campione raccolto in inverno aveva una conta dei batteri totale piuttosto bassa (400000 per millilitro). Tuttavia i micobatteri costituivano un incredibilmente alto 5% della popolazione batterica totale. (La percentuale nelle acque naturali è solitamente inferiore allo 0.1%; il numero di micobatteri trovati nelle acque naturali è di circa 0.1 in 500 ml, mentre il numero totale di batteri va dai 500000 ai 4 milioni per ml [41]).
Oltre a questo, la popolazione di batteri presente nei biofilm sulle pareti della piscina vicino alla superficie conteneva il 30% di micobatteri.
Nell’aria sopra alla piscina, i micobatteri costituivano oltre l’80% della popolazione batterica totale. (L’aria è stata campionata 20 cm circa sopra la superficie; sono stati rivenuti M. avium, M. asiaticum, M. fortuitum, M. gordonae e M. diemhoferi. Le infezioni respiratorie dei lavoratori sono state attribuite principalmente a M. avium, un patogeno umano).
Nessun micobatterio è stato ritrovato nell’aria al di fuori dell’edificio della piscina o nei filtri.
Sulla base di queste misurazioni, sembra che gli abbondanti micobatteri presenti nei biofilm rilasciassero continuamente micobatteri nell’acqua, più velocemente di quelli uccidi dagli sterilizzatori UV e dall’acqua ossigenata. I micobatteri rilasciati dalla piscina contaminata, come aerosol nell’aria, hanno infettato i lavoratori.
L’assenza di micobatteri nei filtri a sabbia è probabilmente dovuta al fatto che i filtri bloccavano i detriti, fornendo quindi sufficiente nutrimento ai batteri normali. (I batteri presenti nei filtri erano gli attesi Sphingomonadaceae, γ-Proteobatteri e β-Proteobatteri).
Quando i ricercatori hanno successivamente riesaminato i filtri con sonde genetiche più sensibili, hanno trovato del materiale genetico dei micobatteri, ma solo in tracce.
La competizione da parte dei batteri comuni ha ridotto la presenza di micobatteri nei filtri ad una quantità insignificante [3].
I protozoi come serbatoio di malattie
Microscopici protozoi nei detriti dell’acquario e nei biofilm sono potenziali serbatoi concentrati di micobatteri patogeni. I rotiferi, i parameci e le amebe si nutrono tutti di batteri, compresi i micobatteri. Tuttavia, a differenza dei batteri comuni che sono uccisi e digeriti dai protozoi, molti micobatteri sopravvivono all’ingestione.
Le amebe sono talvolta usate per studiare l’infettività dei micobatteri. (Sia le amebe sia i macrofagi – cellule del sangue del sistema immunitario – inghiottono e uccidono i batteri comuni, ma i micobatteri sono unici, nel senso che possono sopravvivere e moltiplicarsi all’interno di amebe e macrofagi).
Un ricercatore [1] ha studiato 26 differenti specie di micobatteri – isolate soprattutto in ambiente clinico – per la loro capacità di infettare l’ameba Acanthamoeba polyphaga. Tutti i 26 micobatteri sono sopravissuti e si sono moltiplicati nel protozoo.
Un altro ricercatore [8] ha trovato che M. avium, M. marinum e M. fortuitum – tutti isolati in pazienti umani ammalati – potevano tutti sopravvivere e moltiplicarsi nell’ameba A. castellanii.
Tuttavia, le amebe hanno rapidamenteo ucciso un isolato M. smegmatis, confermando la sua relativa scarsa virulenza.
M. avium è sopravvissuto per oltre tre anni in una coltura sperimentale di amebe, suggerendo che i protozoi possano fornire ai micobatteri un rifugio a lungo termine [30]. Le amebe infette producono cisti infette a loro volta. I micobatteri nelle cisti sono stati visti sopravvivere all’esposizione al cloro [1] e ai trattamenti antibiotici [8].
Colture di cibo vivo, quali parameci e rotiferi, possono diventare infette. Per esempio, un allevamento di pesci zebra, tentando di risalire alla causa di un’infezione di M. marinum, ha trovato il micobatterio nei rotiferi (Brachionus plicatilis) che erano usati per il nutrimento degli avannotti. Le colture di rotiferi provenienti dai venditori erano “pulite”; apparentemente le colture si sono infettate dopo essere entrate nell’allevamento [29].
Le prove suggeriscono che i micobatteri siano più infettivi dopo aver vissuto nei protozoi. Un ricercatore [8] ha provato questo facendo crescere un micobatterio (M. avium) nell’ameba A. castellanii. I micobatteri cresciuti nell’ameba per 2-3 giorni, si sono moltiplicati 5 volte più in fretta rispetto a quelli di controllo, su un terreno di coltura.
E quando sono stati testati su dei topi, i micobatteri cresciuti nelle amebe sono stati in grado di colonizzare l’intestino e crescere significativamente meglio nel fegato e nella milza dei topi, rispetto ai micobatteri di controllo.
I micobatteri che sono rilasciati da un protozoo infetto saranno più aggressivi di quelli che si nutrono innocentemente di rifiuti organici. Infatti un adagio di microbiologia afferma che la crescita batterica in un animale aumenta la sua aggressività.
In questo caso, l’animale non è un pesce, ma il protozoo.
Perciò, mentre molti batteri perdono virulenza senza un ospite animale, i micobatteri la mantengono. Che un acquario contenga o meno pesci, i micobatteri saranno impegnati ad infettare i protozoi, mantenendo e rinvigorendo la loro aggressività.
Ciò detto, i micobatteri non sembrano moltiplicarsi vigorosamente nelle amebe [8] e nelle lumache [28]. Nel discutere i suoi risultati, Cirillo [8] spiega che la migliorata virulenza dei micobatteri è un cambiamento fenotipico transitorio, ovvero un’alterazione temporanea dell’espressione genetica. Pertanto, non sarebbe dovuta ad una mutazione genetica, ovvero ad un cambiamento permanente, molto più preoccupante.
Presenza di micobatteri ambientali nel commercio acquariofilo
Varie ricerche hanno trovato micobatteri ambientali nei pesci d’acquario, dai grossisti ai negozi.
Zanoni [45] ha studiato la presenza di micobatteri nei pesci importati e venduti in Italia.
I pesci, direttamente dal venditore, sono stati raggruppati in lotti di cinque pesci simili (stessa specie e origine) per l’analisi.
Approssimativamente, il 30% dei 127 lotti, rappresentanti 48 specie di pesci marini e d’acqua dolce, contenevano micobatteri. (Omogeneizzati di fegato, milza e reni sono stati messi a coltura alla ricerca di micobatteri).
Solo 3 dei 635 pesci aveva sintomi compatibili con la micobatteriosi.
Ricercatori dalla Slovenia [25] hanno esaminato 107 pesci da negozi di animali. Autopsie con test genetici hanno rivelato che 85 pesci (circa l’80%) avevano micobatteri. Nove dei pesci infetti contenevano M. marinum, generalmente considerato il micobatterio più patogeno.
Ricercatori svedesi [18] hanno sondato pesci d’acquario da otto venditori all’ingrosso della Svezia. In un campionamento di 90 pesci per grossista, sei (75%) avevano micobatteri nei loro pesci.
I micobatteri erano presenti nel 50% dei gruppi guppy, nel 50% dei gruppi di neon e nel 25% dei gruppi di fantail e di ciclidi nani M. ramirezi. Ogni gruppo conteneva 10 pesci. Soprendentemente, il micobatterio più comune era il M. marinum.
Da questi dati, si potrebbe concludere che la maggior parte dei pesci offerti nei negozi d’acquari siano portatori di micobatteri. Tuttavia, questo non implica che i pesci automaticamente contraggano la micobatteriosi.
Immunità
Se i pesci in salute sono portatori di piccoli numeri di micobatteri e molti micobatteri sono potenzialmente patogeni, l’immunità è l’unico fattore realmente protettivo dei pesci.
I pesci possono sviluppare una sostanziale immunità ai micobatteri. Ad esempio, Pasnik [31] ha vaccinato i pesci così da far produrre loro anticorpi contro l’antigene Ag85A, comune a tutti i Mycobacterium.
I ricercatori hanno atteso per lo sviluppo degli anticorpi, che solitamente richiede un paio di settimane, e quindi hanno iniettato ai pesci dei micobatteri (M. marinum) vivi e virulenti.
Tutti i pesci di controllo, non vaccinati, sono morti entro tre settimane, mentre il 90% dei pesci vaccinati era ancora vivo dopo 5 settimane.
Le infezioni da micobatteri non portano automaticamente alla micobatteriosi. (Nella tubercolosi umana, solo il 10% di persone infette da Mycobacterium tuberculosis sviluppa la tubercolosi [35]).
Infatti, un ricercatore [14] ha trovato granulomi guariti e in guarigione in pesci infettati con le specie meno aggressive di micobatteri, M. shottsii e M. gordonae.
La maggior parte di noi può capire intuitivamente che lo stress compromette il sistema immunitario e rende i pesci più vulnerabili alle malattie. Tuttavia, dubito che un breve incidente fonte di stress (come un riscaldatore spento una notte) possa far scoppiare una micobatteriosi.
Una breve soppressione immunitaria causata da uno stress acuto è più probabile causi infezioni da batteri a crescita molto rapida, come gli Aeromonas o gli Pseudomonas. Questi potenziali patogeni sono parte della microflora intestinale dei pesci e dell’ambiente [34] e invaderebbero un pesce stressato e dal sistema immunitario compromesso molto prima che che i micobatteri siano in grado di moltiplicarsi a livelli pericolosi.
Sospetto che la micobatteriosi si sviluppi nei pesci sottoposti a stress prolungati nel tempo, tempo misurato in settimane e mesi, non ore o giorni.
Poiché l’immunità lentamente si indebolisce con l’età, ci si aspetterebbe che i pesci più anziani diventino sempre più vulnerabili alla micobatteriosi. In effetti, la micobatteriosi è diagnosticata più frequentemente nei pesci non più giovani [20].
Ogni acquario ha la sua particolare microflora e contiene diverse combinazioni di specie di micobatteri. Sotto certe condizioni, anche un pesce in salute con un robusto sistema immunitario è vulnerabile. Un pesce in salute può ammalarsi quando viene trasferito in un nuovo acquario, dove è costretto a confrontarsi con nuove specie di micobatteri, alle quali è – immunologicamente parlando – non familiare.
I pesci arcobaleno sembrano particolarmente suscettibili alla micobatteriosi. Un rinomato allevatore di pesci arcobaleno [39], ricorda di aver trasferito metà dei suoi 30 M. trifasciata in ottima salute in un acquarioda 600 litri, ben stabile, contenente pesci in salute.
I 15 pesci hanno sviluppato la micobatteriosi e, in poche settimane, hanno cominciato a morire. Gli unici sintomi erano respiro affannato e ventre gonfio.
Un’autopsia e un esame veterinario degli ultimi 3 infetti rimasti ha confermato la micobatteriosi.
Anche dopo la morte dei nuovi pesci, in questo acquario ci sono stati altri episodi di micobatteriosi. Alla fine, il proprietario ha smantellato l’acquario e lo ha sterilizzato. Nel frattempo, i 15 pesci non trasferiti hanno continuato a godere di buona salute, anche dopo due anni dalla prima epidemia.
Ritengo che, quando i 15 pesci sono stati spostati nell’acquario da 600 litri, non avevano alcuna immunità alla microflora di micobatteri lì presente. Al contrario, i pesci già presenti avevano sviluppato l’immunità.
Sfortunatamente, i pesci trasferiti hanno dato via ad un’infezione nell’acquario. Ammalandosi e morendo, hanno inondato l’acquario di micobatteri – ora con virulenza aumentata – al punto che persino i pesci giò presenti e con una certa immunità si sono ammalati.
L’acquario stesso è diventato “malato”.
Micobatteri negli aerosol e nei biofilm
I micobatteri sono particolarmente abbondanti nella superficie dell’acqua e nei biofilm. L’acqua è semplicemente troppo polare (caricata elettricamente) per questi batteri idrofobici.
I micobatteri si attaccano a microbolle d’aria per salire in superficie. Una volta arrivati in superficie, le bolle d’aria esplodono, espellendo goccioline d’acqua nell’aria [12]. Le goccioline sono abbastanza leggere da essere spostate dalle correnti d’aria.
In precedenza, ho mostrato uno studio dove veniva mostrato che alcuni lavoratori di una piscina erano stati infettati dai micobatteri della piscina.
Nelle fish-room con acquari aperti ed aeratori, si può immaginare che malattie possano essere trasmesse dagli aerosol [23]!
I micobatteri hanno una chiara preferenza nutrizionale verso i lipidi [33] e i lipidi tendono a galleggiare come l’olio, in superficie. Questo fatto, unito all’idrofobicità dei micobatteri, significa che la patina superficiale può essere un grande serbatoio di micobatteri.
Molti pesci si nutrono in superficie, ingerendo perciò grandi quantità di micobatteri ad ogni pasto.
La natura idrofobica dei micobatteri li fa, inoltre, incollare alle superfici, dove formano un biofilm [33].
I ricercatori identificano i biofilm superficiali, sui vetri e sui detriti nel fondo come i maggiori depositi di micobatteri negli allevamenti di pesci zebra [43].
Per questo motivo, ogni volta che cambio l’acqua, per prima cosa rimuovo la patina superficiale rimuovendo l’acqua con un contenitore. Rimuovo anche il biofilm che segna i vetri dell’acquario a livello dell’acqua.
Questi sono i due posti dove è da aspettarsi la maggior presenza di micobatteri [2].
Micobatteri negli allevamenti di pesci zebra (Danio rerio)
Molti laboratori di ricerca usano correntemente i pesci zebra per studiare i fattori di infettività dei micobatteri coinvolti nelle malattie dell’uomo. Ironicamente, vari allevamenti che riforniscono questi laboratori hanno avuto devastanti epidemie di micobatteriosi.
Per prevenire e gestire questi problemi, gli scienziati coinvolti hanno documentato attentamente le loro scoperte. Queste informazioni pubblicate possono essere molto utili per gli acquariofili alle prese con un problema molto complesso.
Prima di tutto, si impara che persino le strutture in grado di fornire le migliori cure ai pesci non sono immuni al problema. Ci saranno sempre potenziali micobatteri patogeni negli acquari e ci saranno sempre pesci vulnerabili.
I lavoratori negli allevamenti, lavorando con svariati acquari, potrebbero non accorgersi di un pesce con una micobatteriosi senza sintomi. Il pesce infetto cronicamente, quindi, comincia a rilasciare in acqua grandi numeri di batteri nella colonia. La micobatteriosi può quindi diffondersi agli altri acquari attraverso schizzi d’acqua o micobatteri negli aerosol oppure attraverso del cibo vibo infetto.
M. marinum ha tormentato un allevamento di pesci zebra per anni [29]. Nel 2010, il problema ha raggiunto il picco quando M. marinum ha infettato tre lavoratori (“sindrome dell’acquario”).
L’epidemia c’è stata nonostante l’allevamento avesse avviato l’attività con uova sterilizzate, usato filtri sterilizzatori, fornito eccellenti cure ai pesci e usato un programma di pesci sentinella. (Per monitorare micobatteriosi latenti, molti allevamenti usano “pesci sentinella” nelle sump, dove ricevono l’acqua direttamente dagli acquari principali, prima di essere filtrata e sterilizzata. I ricercatori quindi effettuano l’autopsia dei pesci sentinella dopo vari mesi e li esaminano alla ricerca di micobatteriosi e altre malattie croniche [23]).
Controlli a campione hanno trovato contaminazioni di M. marinum nella struttura – nelle colture di cibo vivo, nei tubi dell’acqua e persino nella tastiera di un computer nella fish-room.
Come contromisura, l’allevamento ha potenziato i controlli. I pesci sentinella venivano controllati più frequentemente (3 mesi anziché 6). Le colture di cibo vivo sono state spostate lontano dagli acquari per evitare contaminazioni attraverso schizzi o aerosol. Gli acquari con i pesci più vecchi sono stati spostati in basso, mentre quelli con i pesci più giovani (infetti con minore probabilità) sono stati posizionati in alto. I pesci più vecchi di due anni e al termine del periodo riproduttivo sono stati eliminati.
Gli acquari sono stati svuotati e sterilizzati per mezzo del calore ogni tre settimane, per eliminare i biofilm.
I ricercatori hanno studiato attentamente la procedura di sterilizzazione delle uova e hanno osservato che esporre le uova fecondate a 30 ppm di ipoclorito di sodio per 10 minuti era altamente efficace.
Nel 2015, M. marinum non è stato completamente eliminato dall’allevamento ma la diffusione è stata riportata sotto controllo e il suo impatto minimizzato [29].
Distruggere tutti i pesci e ripartire daccapo non elimina i micobatteri ma può eliminare con successo un patogeno radicato. Una specie di M. haemophilum, molto infettiva, ha costretto un allevamento a disinfettare tutto e ripartire con nuovi pesci zebra [43].
Già dopo 4 settimane dall’introduzione dei nuovi pesci (da embrioni sterilizzati), i ricercatori hanno trovato micobatteri. Mesi dopo, cinque specie di micobatteri (M. abscessus, M. chelonae, M. fortuitum, M. gordonae e M. phocaicum/mucogenicum) avevano colonizzato gli acquari e le sump.
Due anni dopo, la totale pulizia sembra aver avuto successo. Ogni tanto, un pesce esaminato rivela micobatteri della specie M. chelonae. Tuttavia non ci sono più epidemie di micobatteriosi o tracce dell’originale M. haemophilum che aveva causato così tanti problemi.
La mia esperienza con la micobatteriosi
Dopo la diagnosi di micobatteriosi nei miei pesci del 2005, ho iniziato a preoccuparmi della mia salute. Sapevo che i batteri avrebbero potuto infettarmi attraverso un qualsiasi taglio sulla pelle, ogni volta che mettevo le mani in acquario. Avevo paura persino della possibilità di avere un’infezione da micobatteri.
La “Fish Tank Syndrome” (sindrome dell’acquario) è una malattia piuttosto comune fra chi maneggia pesci.
Ogni acquariofilo con piaghe sulle mani o sulle braccia che non guariscono in fretta dovrebbe consultare un medico o un veterinario specializzato in pesci.
Un’acquariofila esperta, che conosco, ha contratto la malattia nonostante tutti i suoi pesci apparissero normali.
Per i miei pesci, le cose sono andate peggio. Poiché avevo spostato i pesci prima di sapere avessero la micobatteriosi, la malattia si è diffusa anche nei miei due altri acquari.
I pesci hanno cominciato a mostrare sintomi e a morire. Pensavo di smantellare tutto, disinfettare e ricominciare.
Tuttavia i miei tre acquari stabili contenevano pesci e piante che avevo da anni. Anche se avessi ricominciato daccapo, sarebbe potuto succedere di nuovo.
Incerta sul da farsi, ho deciso di aggiungere un filtro sterilizzatore UV ad ognuno dei tre acquari (170, 190 e 210 litri). Anche se non avessi salvato i pesci, almeno avrei protetto me stessa dall’infezione.
Ho regolato i filtri in maniera che l’acqua dal filtro biologico entrasse nel filtro UV con all’interno una lampada UV da 8-9 watt, prima di ritornare nell’acquario. Ho tenuto le lampade accese 24 ore al giorno, con un lento movimento d’acqua, per massimizzare l’esposizione dalla luce germicida.
I risultati della sterilizzazione con UV sono stati inattesi e fantastici. Non ci sono state altre morti. Le ferite su un paio di pesci sono guarite.
Che la lampada UV stesse uccidendo i micobatteri o altri patogeni responsabili di infezioni secondare era per me irrilevante. I miei pesci stavano guarendo!
Per vedere quanto erano infetti i miei acquari, ho acquistato 8 pesci arcobaleno da una fonte affidabile. Eccetto per una morte, tutti gli altri sono stati bene. Dopo 8 mesi, un veterinario specializzato ha esaminato 3 dei nuovi pesci (tutti Melanotaenia boesemani), uno da ciascun acquario. Un esame istologico ha evidenziato assenza di micobatteriosi. I pesci vecchi non avevano infettato i nuovi.
La rimozione degli sterilizzatori UV qualche mese prima rende questi risultati ancora più interessanti.
Riprodurre pesci malati
Alcuni mesi dopo aver acquistato dei Melanotaenia praecox nell’estate del 2004, ho visto che stavano iniziando ad avere problemi. A novembre, ho allestito in fretta un acquario da riproduzione da 40 litri.
La femmina aveva una piccola massa simile ad un tumore sul suo corpo. Poiché sospettavo potesse avere una malattia infettiva, ho trattato l’acquario con una dose standard (200 mg/giorno per 5 giorni) di antibiotico eritromicina.
Non appena avevano finito di deporre, ho rimosso entrambi dall’acquario. Sono morti poche settimane dopo, tuttavia sono stata capace di far crescere 10 giovani pesci in salute dalle loro uova.
Non sospettavo micobatteriosi all’epoca, dunque il mio successo di riproduzione con questa coppia di pesci arcobaleno è stato solo fortuna.
Mentre una femmina di una specie vivipara trasmette direttamente ai piccoli la micobatteriosi, i pesci arcobaleno e gli altri ovipari non lo fanno [4]. Ogni trasmissione di malattia avviene attraverso i micobatteri presenti nell’acqua o appiccicati alla superficie delle uova.
Credo che il trattamento con eritromicina abbia aiutato. Molti non realizzano che i micobatteri “nudi” (ovvero in sospensione, quindi non in un biofilm o in un’ameba o all’interno di un pesce) siano suscettibili agli antibiotici.
Tant’è vero che Cirillo [8], nei suoi esperimenti ameba-M. avium ha usato 100 μg/ml di Amikacina per uccidere i micobatteri in sospensione nel mezzo di coltura. (L’antibiotico non ha invece alcun effetto sui micobatteri una volta insediati dentro l’ameba).
Un paio d’anni dopo, ho fatto eseguire l’autopsia ad uno dei miei pesci arcobaleno provenienti dalla riproduzione raccontata sopra. Sebbene fosse in buono stato per aspetto e comportamento, questa femmina aveva iniziato a sviluppare una curvatura della spina dorsale.
Basandomi sulla sua storia, ero convinta avesse la micobatteriosi, ma gli esami hanno dimostrato che mi sbagliavo. Non aveva la micobatteriosi.
I risultati dalla sua autopsia e quelli precedenti dai tre M. boesemani, mi hanno alla fine convinta che l’epidemia di micobatteriosi nei miei acquari era ormai conclusa.
Cosa possono fare gli acquariofili con la micobatteriosi?
Prima di tutto, sarei molto cauta all’acquisto dei pesci. Le società di acquari fanno frequentemente aste dove si possono acquistare pesci direttamente dagli allevatori. Allevare pesci direttamente dalle uova è un’altra opzione.
Frequentemente sono stata in grado di accrescere piccoli pesci in salute appena acquistati, che sono poi morti. Alcuni di questi pesci quasi certamente avevano una micobatteriosi.
In secondo luogo, controllerei continuamente alla ricerca di segni di micobatteriosi e la gestirei quanto più velocemente possibile. Bisogna fare in modo che i micobatteri patogeni non riescano a trincerarsi.
La micobatteriosi solitamente compare dopo l’introduzione di nuovi pesci in un acquario stabile.
Anche se i nuovi pesci non sono malati quando acquistati, spesso sono stressati e immunologicamente deboli. Allo stesso momento, devono affrontare un nuovo insieme di micobatteri, contro cui non hanno alcuna immunità. Credo che questo scenario sia adatto a descrivere le cause della micobatteriosi nei miei acquari e nell’allevamento che ho descritto in precedenza [39].
Per prevenire le micobatteriosi, la normale quarantena non è sufficiente. Un pesce infettato di frequente ha sviluppato una certa resistenza ai suoi micobatteri patogeni e dunque può apparire in salute per molti mesi o addirittura non mostrare mai alcun sintomo.
Detto questo, una breve quarantena (2-3 settimane) è meglio di nessuna quarantena e diminuisce enormemente il riscio di introdurre malattie comuni quali l’Ictioftiriasi.
Per far uscire allo scoperto una micobatteriosi, si potrebbe considerare l’opzione di usare un “pesce sentinella” nell’acquario di quarantena.
Raccomanderei inoltre di usare un filtro UV sterilizzatore in ogni acquario con nuovi pesci. Un filtro UV riduce enormemente il numero di micobatteri, riducendo l’esposizione potenziale dei pesci ai micobatteri patogeni. Il nuovo (e spesso stressato) pesce ha così il tempo di sviluppare anticorpi e immunità protettiva alla nuova microflora.
La luce UV sterilizzatrice uccide solamente i microorganismi in sospensione nell’acqua. Non ucciderà i micobatteri nei detriti, nei biofilm o nei pesci infetti.
Tuttavia, gli sterilizzatori UV hanno funzionato nel mio caso. Ho avuto eccellenti risultati con tre marche diverse, seguendo le istruzioni del produttore. Se lo sterilizzatore è in grado di uccidere le alghe verdi [NdT: volvox], dovrebbe uccidere pure i micobatteri, poiché le cellule algali sono meno vulnerabili dei batteri alla luce UV, grazie alle loro dimensioni maggiori e ai pigmenti protettivi [21].
In aggiunta, i raggi UV uccidono indifferentemente i micobatteri e i batteri comuni [26] pertanto – a differenza della disinfezione – non aumentano la sola popolazione di micobatteri.
Alcuni allevamenti di pesci enfatizzano la disinfezione e condizioni di iper-pulizia che ritengo promuovere inevitabilmente i micobatteri.
I miei acquari contengono terriccio, piante e non sono poi così puliti, eccettuata la rimozione della patina superficiale.
Sospetto che molti pesci con una micobatteriosi cronica siano passati nei miei acquari in cinquanta e più anni di hobby acquariofilo.
Nessuno ha causato problemi fino al 2004. Altri acquariofili di lungo corso hanno imparato a gestire la micobatteriosi con successo adottando un simile approccio.
Non c’è una cura praticabile per la micobatteriosi. Lo zoo di Londra ha curato dalla micobatteriosi un prezioso esemplare di pesce polmonato australiano com somministrazioni giornaliere, per otto mesi, di antibiotici (rifampicina, doxiciclina ed enrofloxacina).
La quarantena e un buon allevamento dei pesci sono probabilmente più efficaci del tentativo di eradicare la micobatteriosi.
Ho bloccato l’epidemia di micobatteriosi nei miei acquari usando filtri sterilizzatori UV e rimuovendo prontamente i pesci debilitati.
Tabella 4. Prevenire e gestire la micobatteriosi
- Fornire condizioni ambientali adeguate, che non siano causa di stress per i pesci.
- Quarantenare rigorosamente tutti i nuovi pesci per almeno 2-3 settimane.
- Usare filtri sterilizzatori UV, specialmente in acquari con nuovi pesci o con i primi indizi di problemi.
- Rimuovere prontamente ogni pesce morente o morto.
- Rimuovere la patina superficiale.
- Non usare “feeder fish” [NdT: pesci poco costosi usati come alimento vivo per altri pesci]; sono i primi candidati per la trasmissione di micobatteri.
- Prendere atto che una disinfezione regolare e una ultra-pulizia degli acquari può aumentare il rischio di micobatteriosi.
- Cercare di tenere i pesci giovani lontani da quelli più vecchi.
- Essere consapevoli che la micobatteriosi può essere diffusa dagli aerosol da un acquario all’altro.
Una volta che l’epidemia è tornata sotto controllo, credo che la competizione degli ordinari e più veloci batteri sia sufficiente a limitare i micobatteri. Quindi sono riuscita a contenere la malattia senza distruggere tutti i pesci e senza “bombardare con una testata nucleare” gli acquari.
È mia opinione che conoscere come prevenire e/o gestire la micobatteriosi sia essenziale per un’acquariofilia di successo e duratura.
Riconoscimenti
Per l’aiuto nella stesura di questo articolo, desidererei ringraziare i seguenti scienziati e veterinari: Gregory Lewbart (NC State Univ. in Raleigh); Roy Yanong (Univ. of Florida); Michael Kent (Oregon State Univ.); Joseph Falkinham III (Virginia Polytechnic Institute.); Angelo Colorni (Israel Oceanographic and Limnological Research, Israel); and Ivo Pavlik (Veterinary Research Institute, Czech Republic).
Riferimenti
1. Adekambi T et al. 2006. Survival of environmental mycobacteria in Acanthamoeba polyphaga. Appl Environ Microbiol 72: 5974-5981.
2. Angenent LT et al. 2005. Molecular identification of potential pathogens in water and air of a hospital therapy pool. Proc Natl Acad Sci 102: 4860−4865.
3. Angenent, Lars. Personal communication in 2006.
4. Astrofsky, KM et al. 2000. Diagnosis and management of atypical Mycobacterium spp. Infections in established laboratory Zebrafish (Brachydanio rerio) facilities. Comp Med 50: 666-72.
5. Bardouniotis E, Ceri H. and Olson ME. 2003. Biofilm formation and biocide susceptibility testing of Mycobacterium fortuitum and Mycobacterium marinum. Cur Microbiol 46: 28-32.
6. Beran V et al. 2006. Distribution of mycobacteria in clinically healthy ornamental fish and their aquarium environment. J Fish Dis 29: 383-393.
7. Cangelosi J et al. 2004. Biology of waterborne pathogenic mycobacteria. In: Pedley S et al (eds). Pathogenic Mycobacteria in Water. IWA Publishing (London) for the World Health Organization, pp. 39-54.
8. Cirillo JD et al. 1997. Interaction of Mycobacterium avium with environmental amoebae enhances virulence. Infect Immun 65: 3759-67.
9. Dailloux M, Laurain C, Weber M and Haretmann PH. 1999. Water and Nontuberculous Mycobacteria. Water Research 33: 2219-28.
10. Davis JM, Clay H, Lewis JL, Ghori N, Herbomel P and Ramakrishnan L. 2002. Real-time visualization of Mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity 17: 693-702.
11. Falkinham JO et al. 2001. Factors influencing numbers of Mycobacterium avium, Mycobacterium intracellulare, and other mycobacteria in drinking water distribution systems. Appl Environ Microbiol 67: 1225-31.
12. Falkinham JO, III. 2009. Surrounded by mycobacteria: nontuberculous mycobacteria in the human environment (Review). J Appl Microbiol 107: 356-367.
13. Francis-Floyd, R and Yanong R. 1999. Mycobacteriosis in Fish. University of Florida. http://edis.ifas.ufl.edu/VM055
14. Gauthier, DT et al. 2003. Experimental mycobacteriosis in striped bass Morone saxatilis. Dis Aquat Organisms 54: 105-17.
15. Gomez S. 2008. Prevalence of microscopic tubercular lesions in freshwater ornamental fish exhibiting clinical signs of non-specific chronic disease. Dis Aquat Organisms 80: 167-171.
16. Griffith DE. 2010. Nontuberculous mycobacterial lung disease. Curr Opin Infect Dis 23: 185-190.
17. Harriff MJ et al. 2007. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: a potential model for environmental mycobacterial infection. J Fish Dis 30: 587-600.
18. Hongslo T and E Jansson. 2016 Mycobacteria occurrence in aquarium fish from Swedish wholesalers. Bull. Eur. Assoc. Fish Pathol. 36: pp. –.
19. Kazda J, Pavlik I, Falkinham III JO, Hruska K (editors). 2009. The Ecology of Mycobacteria: Impact on Animal’s and Human’s Health. Springer Publishers (New York), p. 9.
20. Kazda (2009), p. 236.
21. Kaiser E and Herndl GJ. 1997. Rapid recovery of marine bacterioplankton activity after inhibition by UV radiation in coastal waters. Appl Environ Microbiol 63: 4026-4031.
22. Kent ML et al. 2004. Mycobacteriosis in zebrafish (Danio rerio) research facilities. Comp Biochem Physiol 138: 383-90.
23. Kent ML, Whipps CM et al. 2009. Recommendations for control of pathogens and infectious diseases in fish research facilities. Comp Biochem Physiol, Part C 149: 240-248.
24. Kirschner RA Jr et al. 1992. Epidemiology of infection by nontuberculous mycobacteria. Am Rev Respir Dis 145: 271-275.
25. Kušar D… M Pate. 2016. Mycobacteria in aquarium fish: results of a 3-year survey indicate caution required in handling petshop fish. J Fish Diseases DOI: 10.1111/jfd.12558
26. LeChevallier MW. 2004. Control, treatment and disinfection of Mycobacterium avium complex in drinking water. In: Pedley S et al (eds). Pathogenic Mycobacteria in Water. IWA Publishing (London), pp. 143-168.
27. Lescenko P et al. 2003. Mycobacterial infection in aquarium fish. Vet Med 48: 71-78.
28. Marsollier L et al. 2004. Aquatic snails, passive hosts of Mycobacterium ulcerans. Appl Environ Microbiol 70: 6296-98.
29. Mason T,…Kent ML, Whipps CM, and Peirce J. 2016. Strategies to mitigate a Mycobacterium marinum outbreak in a zebrafish research facility. Zebrafish 13: S77-S87. {Disponibile per il download gratuito a: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4931754/}
30. Mura M et al. 2006. Replication and long-term persistence of bovine and human strains of Mycobacterium avium subsp. paratuberculosis within Acanthamoeba polyphaga. Appl Envir Microbiol 72: 854-859.
31. Pasnik DJ and Smith SA. 2005. Immunogenic and protective effects of a DNA vaccine for Mycobacterium marinum in fish. Vet Immunol Immunopathol 103: 195-206.
32. Perez, AT et al. 2001. Presence of acid-fast bacteria in wild and cultured silver mullets (Mugil curema VAL., 1836) from Margarita Island Venezuela. Interciencia 26: 252-256.
33. Primm TP et al. 2004. Health impacts of environmental mycobacteria. Clin Microbiol Rev 17: 98-106.
34. Rawls JF et al. 2004. Gnotobiotic zebrafish reveal evolutionarily conserved responses to the gut microbiota. Proc Natl Acad Sci 101: 4596- 4601.
35. Rom, WN and SM Garay (Eds.). 2004. Tuberculosis (2nd Ed). Lippincott Williams & Wilkins (New York), p. 17 (of 944 pp).
36. Sakai M et al. 2005. Characterization of a Mycobacterium sp isolated from guppy Poecilia reticulate, using 16S ribosomal RNA and its internal transcribed spacer sequences. Bull Eur Assoc Fish Path 25: 64-69.
37. Steinert M et al. 1998. Mycobacterium avium Bacilli grow saprozoically in coculture with Acanthamoeba polyphaga and survive within cyst walls. Appl Environ Microbiol 64: 2256-2261.
38. Strike, TB et al. 2017. Investigation and management of an outbreak of multispecies mycobacteriosis in Australian lungfish (Neoceratodus fosteri) including the use of triple antibiotic treatment. J Fish Dis 40: 557-70.
39. Tappin, Adrian R. Rainbowfishes. Their Care and Keeping in Captivity. 2010. Art Publications, pp. 450-551.
40. Watral V and Kent ML. 2007. Pathogenesis of Mycobacterium spp. in zebrafish (Danio rerio) from research facilities. Comp Biochem Physiol, Part C 145: 55-60.
41. Wetzel RG. 2001. Limnology. Lake and River Ecosystems (Third Ed.). Academic Press (New York), p. 493.
42. Whipps CM… Kent ML. 2008. Distribution and genetic characterization of Mycobacterium chelonae in laboratory zebrafish Danio rerio. Dis Aquatic Organisms 82: 45-54.
43. Whipps CM… Wagner R. 2012. Mycobacteriosis in zebrafish colonies. ILAR Journal 53: 95-105.
44. Wolinsky E. 1973. Mycobacteria. In: Davis BD, Dulbecco R, Eisen H, Ginsberg HS, Wood BW, and McCarty M (eds), Microbiology (2nd Ed); Harper & Row (Hagerstown MD), pp 844-69.
45. Zanoni RG et al. 2008. Occurrence of Mycobacterium spp. in ornamental fish in Italy. J Fish Dis 31: 433-441.